
Illustration von McCall Sarrett
Ganz gleich, ob Sie die 20-Jahre Ihres Lebens vergessen oder alle fünf Minuten das gleiche Gespräch führen, um es jedes Mal zu vergessen. Gedächtnisstörungen können den Alltag stark beeinträchtigen. Es kann einer der verwirrendsten Aspekte der Neurodegeneration sein und ist ein Schlüsselsymptom der Demenz.
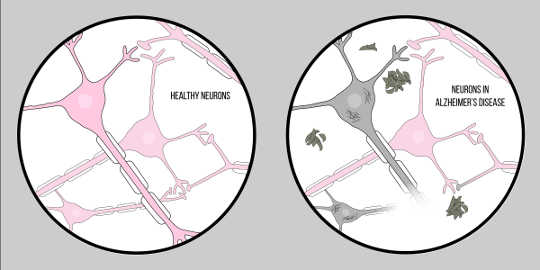
Alzheimer-Krankheit, auch bekannt als ADist die häufigste Form von Demenz, die durch kognitive Schwierigkeiten und Gedächtnisverlust gekennzeichnet ist. Derzeit gibt es keine offizielle klinische Technik zur Diagnose von AD, außer einer Autopsie. Es gibt jedoch zwei charakteristische Merkmale des Gehirngewebes von Alzheimer-Patienten: Amyloid Beta (A?) Plaques und neurofibrilläre Verwicklungen, die beide einen wesentlichen Einblick in die Pathologie der Neurodegeneration lieferten.
"Neurofibrilläre Verwicklungen entstehen durch einen Defekt in Proteinen, den sogenannten Tau-Proteinen."
A? ist ein Protein, das aus entsteht Proteolyse of Amyloid-Vorläuferprotein (APP). Dies bedeutet, dass APP in kleinere Fragmente zerschnitten wird, von denen eines das A? Fragment. APP wird durch Enzyme, sogenannte Sekretasen, in diese Stücke zerschnitten. Ihre Hauptaufgabe besteht darin, diese Proteine zu spalten. Es gibt verschiedene Sekretasen, aber es gibt eine, die für die Alzheimer-Pathologie von Bedeutung ist – die Gamma-Sekretase. Gamma-Sekretase produziert eine spezielle Form von A?: A?-42, die giftigste Form des Proteins. Nach dem Aufbrechen beginnen sich diese Proteinfragmente im Raum außerhalb der Zellen anzusammeln. Der Schlüssel zur Toxizität dieser Proteine liegt darin, dass sie charakteristischerweise „klebrig“ sind und daher beginnen, Aggregate zu bilden. Diese Aggregate entwickeln sich weiter, und schon bald sind überall diese Amyloid-Beta-Plaques zu finden, die die neuronale Funktion stark beeinträchtigen.
 Figur von McCall Sarrett
Figur von McCall Sarrett
Dieser Einfluss von A? auf die neurologische Funktion hat dazu geführt Amyloid-Hypothese, eine anerkannte Theorie, die eine Erklärung für die Neurodegeneration bei Alzheimer vorschlägt.
Nun zum zweiten Schlüsselmerkmal: neurofibrilläre Verwicklungen. Neurofibrilläre Verwicklungen entstehen aus einem Defekt in Proteinen, den sogenannten Tau-Proteinen. Tau-Proteine dienen als Brücke zwischen den als Mikrotubuli bezeichneten Strukturen in der Zelle. Mikrotubuli sind Trägermoleküle, die den Zellen, insbesondere Axonen, Form und Struktur verleihen. Tau-Proteine helfen diesen Mikrotubuli dabei, die Axone zu strukturieren. Im Fall von Alzheimer-KrankheitBei einer neurodegenerativen Erkrankung, die durch neuronalen Verlust gekennzeichnet ist, scheiden sich Tau-Proteine im Zellkörper ab, der auch als Soma bezeichnet wird. Dies führt zu einer Degeneration der Axone, wodurch die Kommunikation der Neuronen noch schwieriger wird. Diese Schwierigkeit bei der neuronalen Kommunikation ähnelt der Wirkung von Amyloid Beta; Es ist jedoch wichtig anzumerken, dass diese Verwicklungen sich stark von den zuvor diskutierten Plaques unterscheiden, indem sie die Kommunikation von innerhalb der Zelle nach außen beeinflussen.
"Die Wissenschaftler wissen noch nicht genau, welchen Mechanismus sie für die Pathologie der Alzheimer-Krankheit verantwortlich machen."
Obwohl beide äußerst einflussreich sind, ist A? und Tau sind nicht die einzigen relevanten Faktoren, wenn es um die Pathologie von Alzheimer geht. Studien haben gezeigt, dass das Apolipoprotein E (APOE) Gen könnte genauso einflussreich sein wie A?. Es gibt drei Hauptvarianten, die für Proteine kodieren: ApoE2, ApoE3 und ApoE4. Es wurde gezeigt, dass ApoE4 mit einer Abnahme der synaptischen Beschneidung korreliert, während ApoE2 zu einer Zunahme führt. Beide Formen beeinflussen Astrozyten (wichtig Gliazellen innerhalb des Nervensystems) und korrelieren mit ihrer Phagozytoserate, dem Prozess, durch den die AstrozytenSternförmige Gliazellen, die eine Reihe von Funktionen haben, umfassen Zellmaterial. Jede ApoE-Variante beeinflusst direkt diese Phagozytose-Rate, ApoE2, was zu einer Erhöhung führt, und ApoE4, eine Abnahme. Dies legt nahe, dass die Astrozyten möglicherweise weniger in der Lage sind, die in der Zelle schwebenden Trümmer zu "reinigen", wenn sie mit ApoE4 korreliert werden. Wenn sich diese Plaques aufbauen, kann der ApoE4-Genotyp daher die Clearance dieser Aggregate verhindern und zur Degeneration beitragen.
Amyloid Beta, Tau und verschiedene Gene arbeiten alle zusammen, um ein Hauptproblem der Kommunikation zwischen den Zellen zu verursachen, was im Wesentlichen die Krankheit ist, die wir als Alzheimer-Krankheit kennen. Eine solche Neurodegeneration tritt am häufigsten in Bereichen des Gehirns auf, die mit Lernen und Gedächtnis assoziiert sind, breitet sich jedoch im gesamten Gehirn aus. Mit diesem Mangel an Kommunikation kommt es zu einem Verlust von Synapsen und schließlich zu einer Abnahme der Gehirnsubstanz. Daher ist es normal, ein vermindertes Hirngewebe auf einem zu sehen MRIDie Magnetresonanztomographie, eine Technik zur Betrachtung der Struk ... im Verlauf der Erkrankung, zeigt, dass Alzheimer das Gehirn buchstäblich zusammenzieht. Unsere aktuellen Lern- und Gedächtnismodelle spielen eine Schlüsselrolle in diesen Prozessen und bieten eine mögliche Erklärung dafür, wie diese Pathologie mit den Hauptsymptomen von AD, wie Gedächtnisverlust, korreliert.
Den genauen Mechanismus, der für die Pathologie der Alzheimer-Krankheit verantwortlich ist, wissen die Wissenschaftler noch nicht. Es wurden viele innovative Methoden erforscht, um weitere Erkenntnisse über diesen pathologischen Punkt zu gewinnen, darunter Biomarker für Liquor (Cerebrospinalflüssigkeit).
A-Level? und Tau kann im Liquor durch ein Verfahren namens Lumbalpunktion gemessen werden, bei dem Gehirn-Rückenmarks-Flüssigkeit gesammelt wird. Erhöhte Tau-Spiegel und verringerte A?-Spiegel werden bei Patienten mit Alzheimer-Krankheit beobachtet. Dies ist ein Ergebnis des A? Ansammlungen im Gehirn, was wiederum zu einer verminderten Konzentration im Liquor führt. Diese Daten deuten darauf hin, dass Ärzte und Wissenschaftler in Zukunft möglicherweise in der Lage sein könnten, den kognitiven Zustand eines Patienten vorherzusagen, indem sie den Proteingehalt im Liquor untersuchen.
Derzeit gibt es keine endgültige Heilung für die Alzheimer-Krankheit. Zunehmendes Wissen über die beteiligten pathologischen Proteine, assoziierte Gene und laufende wissenschaftliche Forschung lassen jedoch auf eine effektive Behandlung in der Zukunft hoffen.
Welchen Durchbruch sollten Ihrer Meinung nach Medikamente für eine Alzheimer-Behandlung benötigen? Lass es uns in den Kommentaren wissen!
Dieser Artikel erschien ursprünglich auf Neuronen kennen?
Über den Autor
Khayla Black ist ein Neuling an der New York University in Shanghai und plant, einen Studienzweig der Neurowissenschaften mit einem Minor in Data Science mit einer Konzentration auf künstliche Intelligenz zu erklären. In der Zukunft hofft sie auf einen MD / PhD und eine Neurowissenschaftlerin, die sich mit den molekularen Aspekten von Lernen und Gedächtnis beschäftigt. In ihrer Freizeit arbeitet Khayla gerne mit der MYELIN-Initiative innerhalb von IYNA zusammen und liest alle Materialien im Bereich der Neurowissenschaften. Neben ihrem Studium der Neurowissenschaften genießt sie das Laufen, unterrichtet an örtlichen Grundschulen, löst mathematische Probleme und trinkt immense Mengen Kaffee.
Bücher zum Thema
at InnerSelf Market und Amazon
Bibliographie
Lacor, PN, Buniel, MC, Furlow, PW, Clemente, AS, Velasco, PT, Wood, M., . . . Klein, WL (2007, 24. Januar). A? Oligomer-induzierte Aberrationen in Synapse Zusammensetzung, Form und Dichte liefern eine molekulare Basis für den Verlust der Konnektivität bei der Alzheimer-Krankheit. Abgerufen von http://www.jneurosci.org/content/27/4/796
Murphy, MP, & LeVine, H. (2010). Alzheimer-Krankheit und das ?-Amyloid-Peptid. Journal of Alzheimer's Disease?: JAD, 19(1), 311. http://doi.org/10.3233/JAD-2010-1221
O'Brien, RJ & Wong, PC (2011). Amyloid-Vorläuferprotein-Verarbeitung und Alzheimer-Krankheit. Jahresrückblick der Neurowissenschaften, 34185-204. http://doi.org/10.1146/annurev-neuro-061010-113613
Chung, W.-S., Verghese, PB, Chakraborty, C., Joung, J., Hyman, BT, Ulrich, JD, ... Barres, BA (2016). Neue Allel-abhängige Rolle für APOE bei der Kontrolle der Rate von SynapseVerbindungen zwischen Neuronen, bei denen ein Signal weitergeleitet wird, ... durch Astrozyten beschneiden. Proceedings of the National Academy of Sciences der Vereinigten Staaten von Amerika, 113(36), 10186-10191. http://doi.org/10.1073/pnas.1609896113
Zetterberg, H. (2009, 19. August). Amyloid? und APP als Biomarker für die Alzheimer-Krankheit. Abgerufen von https://www.sciencedirect.com/science/article/pii/S0531556509001594?via=ihub























