
Sie sehen es jeden Tag in der Werbung: Cremes und Lotionen zur Reduzierung von Falten, Farbstoffe zur Beseitigung grauer Haare und Heilmittel zur Linderung von Muskel- und Gelenkschmerzen. Neben diesen oberflächlichen Veränderungen wirkt sich das Älterwerden auch auf die innere Physiologie des Körpers aus, einschließlich einer zunehmenden Entzündung im Gehirn (Czirr & Wyss-Coray, 2012), einer Degeneration der Netzhaut (Hoh Kam et al., 2010) und der Durchlässigkeit von die Darmwände (Ma et al, 1992). Viele Industrien werden mit dem Ziel aufgebaut, die Zeichen des Alterns umzukehren. Aber gibt es eine Möglichkeit, den Auswirkungen des Alterns im Körper auf einer tieferen Ebene entgegenzuwirken, als sich die Haare zu färben? Eine Gruppe von Wissenschaftlern schlägt einen einzigartigen Weg vor, um die altersbedingten Folgen im Gehirn mithilfe des fäkalen Mikrobiota-Transfers zurückzudrehen (FMT; Parker et al., 2022).
FMT verwendet die Prinzipien der Parabiose (siehe einen verwandten Knowing Neurons-Artikel hier!), um Darmmikrobiome, definiert als die Gesamtheit der im gesunden Darm lebenden Bakterien und Mikroorganismen (Sommer et al, 2013), zwischen alten und jungen Mäusen auszutauschen. Um ihre Hypothese zu testen, dass die Verwendung von FMT zur Veränderung des Darmmikrobioms Entzündungen im Gehirn und Körper verändert, verwendeten Parker und Kollegen ein Mausmodell mit 3 Monate alten Mäusen (junge Mäuse) und 24 Monate alten Mäusen (alte Mäuse). ). Vor Beginn des Experiments sammelten die Forscher zunächst Fäkalien, um die Basislinie für junge und alte Mausmikrobiome festzulegen. Anschließend erhielten die Mäuse drei Tage lang Antibiotika, um die Bakterien in ihrem Darm zu reduzieren. Nach der Antibiotikabehandlung sammelten die Forscher eine weitere Kotprobe. Nach diesen Anfangsschritten wurden zwei FMT-Runden durchgeführt, bei denen verflüssigter Kot nasal verabreicht wurde und die Mäuse entsprechend ihrer Versuchsgruppe in Käfige gesetzt wurden, die Kot enthielten. Die experimentellen Gruppen in dieser Studie waren gealterte Mäuse, die FMT von jungen Mäusen erhielten, und junge Mäuse, die FMT von gealterten Mäusen erhielten, während die Kontrollgruppen junge Mäuse waren, die FMT von anderen jungen Mäusen oder eine nicht-fäkale Kontrolllösung (als junge Kontrollmäuse bezeichnet) erhielten und gealterte Mäuse, die FMT von anderen gealterten Mäusen oder eine nicht-fäkale Kontrolllösung erhalten (als gealterte Kontrollmäuse bezeichnet). Nach der FMT wurde der Kot fünf Tage und zwei Wochen später gesammelt. Dieses experimentelle Design ermöglichte es den Forschern zu untersuchen, wie sich das Alter des Darmmikrobioms auf Prozesse im Gehirn, in der Netzhaut und im Darm auswirkt.
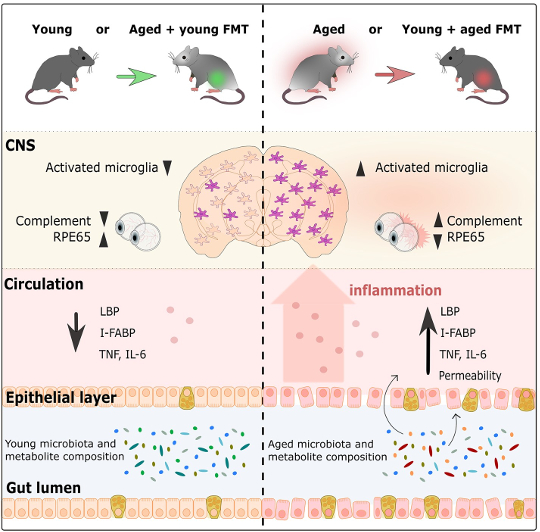
Grafische Zusammenfassung von Parker et al., 2022
…infundiert man eine gealterte Maus mit einem jungen Mikrobiom, wird die altersbedingte Immunantwort rückgängig gemacht.
Die Forscher untersuchten zunächst, wie FMT die Entzündungsreaktion von Mikroglia, den im Gehirn ansässigen Immunzellen, im Cortex und Corpus Callosum (ein riesiges Bündel von Neuronen, das es den beiden Seiten des Gehirns ermöglicht, miteinander zu kommunizieren) beeinflusst (Heneka et al., 2019 ; Erny et al., 2015). Ältere Kontrollmäuse hatten mehr aktivierte Mikroglia als junge Kontrollmäuse, was den Prozess des normalen Alterns widerspiegelt. Allerdings hatten gealterte Mäuse mit jungen Mikrobiomen eine viel geringere Mikroglia-Aktivierung als gealterte Kontrollmäuse. Überraschenderweise war die Mikroglia-Reaktion ziemlich ähnlich zu der, die bei jungen Kontrollmäusen beobachtet wurde. Dasselbe Muster zeigte sich auch in der entgegengesetzten Richtung, da junge Mäuse mit gealterten Mikrobiomen eine viel stärkere Mikroglia-Aktivierung aufwiesen als junge Kontrollmäuse, stattdessen ähnlich wie bei gealterten Kontrollmäusen. Dies zeigt, dass das Alter des Mikrobioms die Immunantwort im Gehirn beeinflusst und dass die Infusion einer gealterten Maus mit einem jungen Mikrobiom die mit dem Alter beobachtete Immunantwort rückgängig macht. In ähnlicher Weise beschleunigt die Gabe eines gealterten Mikrobioms an eine junge Maus die Wirkung des Alters auf die Immunzellen des Gehirns.
…das Mikrobiom beeinflusst altersbedingte Prozesse in der Netzhaut…
Neben der Untersuchung des Gehirns untersuchten die Forscher auch, wie sich das Alter des Darmmikrobioms auf die Netzhaut auswirkt. Generell zeigte sich, dass ältere Mäuse im Vergleich zu jungen Mäusen vermehrt Entzündungen in der Netzhaut aufwiesen. Nach der FMT zeigten gealterte Mäuse mit jungen Mikrobiomen jedoch ähnliche Netzhautentzündungswerte wie junge Kontrollmäuse. Analog zu den Befunden im Gehirn war auch das Gegenteil der Fall. Junge Mäuse mit gealterten Mikrobiomen hatten eine Netzhautentzündung, die gealterten Kontrollmäusen ähnelte. Das Darmmikrobiom beeinflusst auch einen anderen Teil des visuellen Systems: die Fähigkeit der Photorezeptoren, sich in der Netzhaut mit Hilfe des RPE65-Proteins zu regenerieren, dessen Produktion bekanntlich auch mit zunehmendem Alter abnimmt (Cai et al, 2009). Bei gealterten Mäusen mit jungen Mikrobiomen war im Vergleich zu gealterten Kontrollmäusen eine erhöhte Menge des RPE65-Proteins vorhanden. Tatsächlich waren diese Proteinspiegel den Spiegeln bei jungen Mäusen ähnlich. Darüber hinaus hatten junge Mäuse mit gealterten Mikrobiomen viel weniger RPE65 als junge Kontrollmäuse, mit Proteinspiegeln, die mit denen bei gealterten Mäusen vergleichbar waren. Insgesamt zeigt dies, dass das Mikrobiom altersbedingte Prozesse in der Netzhaut beeinflusst, wobei junge Mikrobiome die mit dem Altern verbundenen Prozesse umkehren und gealterte Mikrobiome beschleunigen.
Auch ein weiteres wichtiges Organ, der Darm, bleibt von den Auswirkungen des Alterns nicht verschont: Die Zellschicht, die die Darmwand bildet, wird mit der Zeit undicht (Cui et al, 2019; Thevaranjan et al, 2017). Im Laufe des Alterns nimmt die Stabilität der Darmwand ab und wird durchlässiger, wodurch Bakterien in die Peripherie austreten können, was wiederum die Gesamtentzündung verstärkt (Cui et al, 2019; Thevaranjan et al, 2017). In dieser Studie zeigten die Forscher, dass das Alter des Mikrobioms die Stabilität der Darmwände beeinflusst. Bei gealterten Mäusen mit einem jungen Mikrobiom war der Darm weniger undicht als bei gealterten Kontrollmäusen. Tatsächlich war die Darmpermeabilität bei gealterten Mäusen mit einem jungen Mikrobiom ähnlich der bei jungen Mäusen beobachteten Permeabilität. Ältere Mäuse mit jungen Mikrobiomen wiesen ebenfalls Entzündungsgrade und Anzeichen von Bakterien im Blut auf, ähnlich wie bei jungen Mäusen. Wieder einmal verhielt sich der Darm von jungen Mäusen mit gealterten Mikrobiomen ähnlich wie von gealterten Mäusen mit gealterten Mikrobiomen, indem er einen undichteren Darm und mehr Entzündungen aufwies als junge Mäuse mit jungen Mikrobiomen. Diese Ergebnisse stützen die Hypothese, dass gealterte Mikrobiome zur Erhöhung der Darmpermeabilität beitragen, was eine Zunahme der Entzündung erleichtert, indem es Bakterien ermöglicht, in den Blutkreislauf einzudringen. Wichtig ist, dass die Einführung eines jungen Mikrobioms durch FMT diese altersbedingten Effekte umkehrt.
…das Alter des Darmmikrobioms wirkt sich auf die Funktionen des Gehirns, der Netzhaut und des Darms aus.
Die Ergebnisse der Studie zeigen, dass das Alter des Darmmikrobioms die Funktionen des Gehirns, der Netzhaut und des Darms beeinflusst. Doch wie unterscheiden sich junge und alte Mikrobiome voneinander? Um diese Frage zu beantworten, sequenzierten die Forscher die DNA des Mikrobioms, das in den im Laufe des Experiments gesammelten Kotproben gefunden wurde. Das junge und das alte Mikrobiom hatten bereits vor dem Auftreten von FMT unterschiedliche genetische Ausstattungen, aber FMT veränderte die genetische Zusammensetzung beider Mikrobiome signifikant. Junge Mäuse mit gealtertem Mikrobiom hatten eine sehr ähnliche Zusammensetzung wie gealterte Kontrollmäuse, während die genetische Zusammensetzung in gealterten Mäusen mit jungem Mikrobiom anders war als in gealterten Kontrollmäusen und sich auch von jungen Mäusen mit jungem Mikrobiom unterschied – sie lagen irgendwo dazwischen. Gealterte Kontrollmäuse und junge Mäuse mit gealterten Mikrobiomen hatten hauptsächlich Bakterien von der Oscillibacter und Prevotella Gattung, Firmicutes Stamm und Lactobacillus johnsonii Arten, während junge Kontrollmäuse und gealterte Mäuse mit jungen Mikrobiomen hauptsächlich Bakterien von der hatten Bifidobacterium, Ackermansie, Parabacteroides, Clostridium und Enterococcus Gruppen. Bei der Untersuchung der möglichen Ursache dieser altersbedingten Veränderungen stellten die Forscher fest, dass sich die an der Lipid- und Vitaminproduktion beteiligten Wege (die auf von Bakterien produzierten Metaboliten beruhen) zwischen alten und jungen Mikrobiomen unterschieden. Diese Beobachtung hat einen Nachteil – die Veränderungen in der Häufigkeit verschiedener Arten von Bakterien und ihrer potenziellen Funktion im Darm waren nicht von langer Dauer, da es zwei Wochen nach der FMT keine großen Unterschiede zwischen der Zusammensetzung des Mikrobioms gab.
Insgesamt zeigte diese Studie, dass das Darmmikrobiom altersbedingte Prozesse in Gehirn, Auge und Darm beeinflusst. Gealterte Mikrobiome, unabhängig vom Alter der Empfängermaus, führten zu mehr Entzündungen im Gehirn, in der Netzhaut und im Darm, zu einem geringeren Regenerationspotenzial der Photorezeptoren in der Netzhaut und zu mehr Bakterien, die aus dem Darm austreten. Andererseits kehrte die Einführung junger Mikrobiome in gealterte Mäuse diese Alterungseffekte um. Dies kann auf die Unterschiede in der bakteriellen Zusammensetzung alter und junger Mikrobiome und die Auswirkungen zurückzuführen sein, die diese Veränderungen auf die für die Lipid- und Vitaminproduktion verantwortlichen Wege haben können. Eine Frage, die in dieser Studie nicht angesprochen wurde, war, wie sich das Alter des Mikrobioms auf die kognitive Leistung auswirkt, da sich weder Kontrollmäuse noch FMT-Mäuse in Verhaltensgedächtnistests anders verhielten. Zukünftige Forschung sollte sich auch auf diese Frage konzentrieren, da bekannt ist, dass Kognition und Gedächtnis mit dem Alter abnehmen, und das Verständnis der Rolle des Mikrobioms beim altersbedingten kognitiven Rückgang wichtige Einblicke in mögliche biologische Grundlagen liefern könnte. Eine weitere Richtung, die zukünftige Forschungsfragen verfolgen sollten, wäre der Einfluss der Ernährung auf die Zusammensetzung des Darmmikrobioms. Frühere Studien haben gezeigt, dass verschiedene Ernährungsweisen die Arten von Mikroben im Darm sowohl kurzfristig (David et al., 2014) als auch langfristig (Wu et al., 2011) verändern. Wenn eine Ernährungsumstellung die Zusammensetzung des Darmmikrobioms verändern kann, was wäre, wenn sie auch diese Zeichen der Alterung im Gehirn, in der Netzhaut und im Darm reduzieren könnte?
Wenn eine Ernährungsumstellung die Zusammensetzung des Darmmikrobioms verändern kann, was wäre, wenn sie auch diese Zeichen der Alterung im Gehirn, in der Netzhaut und im Darm reduzieren könnte?
Über den Autor
Geschrieben von Holly Korthas, Veranschaulicht durch Federica Raguseo, Bearbeitet von Johanna Popp, Sarah Wade und Lauren Wagner
Bibliographie
Cai, X., Conley, SM, & Naash, MI (2009). RPE65: Rolle im Sehzyklus, menschliche Netzhauterkrankungen und Gentherapie. Augengenetik, 30(2), 57-62. https://doi.org/10.1080/13816810802626399
Cui, H., Tang, D., Garside, GB, Zeng, T., Wang, Y., Tao, Z., Zhang, L., & Tao, S. (2019). Wnt-Signalisierung vermittelt die altersbedingte Differenzierungsstörung von Darmstammzellen. Stammzellbewertungen und -berichte, 15(3), 448-455. https://doi.org/10.1007/s12015-019-09880-9
Czirr, E., & Wyss-Coray, T. (2012). Die Immunologie der Neurodegeneration. Das Journal der klinischen Untersuchung, 122(4), 1156-1163. https://doi.org/10.1172/JCI58656
David, L., Maurice, C., Carmody, R. et al. Die Ernährung verändert schnell und reproduzierbar das menschliche Darmmikrobiom. Natur 505, 559-563 (2014). https://doi-org.proxy.library.georgetown.edu/10.1038/nature12820
Erny, D., Hrab? de Angelis, AL, Jaitin, D., Wieghofer, P., Staszewski, O., David, E., Keren-Shaul, H., Mahlakoiv, T., Jakobshagen, K., Buch, T., Schwierzeck, V ., Utermöhlen, O., Chun, E., Garrett, WS, McCoy, KD, Diefenbach, A., Staeheli, P., Stecher, B., Amit, I. & Prinz, M. (2015). Die Mikrobiota des Wirts kontrolliert ständig die Reifung und Funktion der Mikroglia im ZNS. Nature Neuroscience, 18(7), 965-977. https://doi.org/10.1038/nn.4030
Heneka MT (2019). Mikroglia stehen im Mittelpunkt neurodegenerativer Erkrankungen. Natur Bewertungen. Immunologie, 19(2), 79-80. https://doi.org/10.1038/s41577-018-0112-5
Hoh Kam, J., Lenassi, E., & Jeffery, G. (2010). Alternde Augen betrachten: verschiedene Orte der Amyloid-Beta-Akkumulation in der alternden Mausretina und die Hochregulierung von Makrophagen. PloS Eins, 5(10), e13127. https://doi.org/10.1371/journal.pone.0013127
Ma, TY, Hollander, D., Dadufalza, V., & Krugliak, P. (1992). Wirkung von Alterung und Kalorienrestriktion auf die Darmpermeabilität. Experimentelle Gerontologie, 27(3), 321-333. https://doi.org/10.1016/0531-5565(92)90059-9
Parker, A., Romano, S., Ansorge, R., Aboelnour, A., Le Gall, G., Savva, GM, Pontifex, MG, Telatin, A., Baker, D., Jones, E., Vauzour , D., Ruder, S., Blackshaw, LA, Jeffery, G., & Carding, SR (2022). Der Transfer von fäkaler Mikrobiota zwischen jungen und alten Mäusen kehrt die Kennzeichen des alternden Darms, Auges und Gehirns um. microbiome, 10(1), 68.
https://doi.org/10.1186/s40168-022-01243-w
Sommer, F. & Bäckhed, F. (2013). Die Darmmikrobiota – Meister der Wirtsentwicklung und -physiologie. Natur Bewertungen. Mikrobiologie, 11(4), 227-238. https://doi.org/10.1038/nrmicro2974
Thevaranjan, N., Puchta, A., Schulz, C., Naidoo, A., Szamosi, JC, Verschoor, CP, Loukov, D., Schenck, LP, Jury, J., Foley, KP, Schertzer, JD, Larché, MJ, Davidson, DJ, Verdú, EF, Surette, MG, & Bowdish, DME (2017). Altersbedingte mikrobielle Dysbiose fördert die Darmpermeabilität, systemische Entzündung und Makrophagen-Dysfunktion. Cell Host & Microbe, 21(4), 455–466.e4. https://doi.org/10.1016/j.chom.2017.03.002
Wu, GD, Chen, J., Hoffmann, C., Bittinger, K., Chen, YY, Keilbaugh, SA, Bewtra, M., Knights, D., Walters, WA, Knight, R., Sinha, R. , Gilroy, E., Gupta, K., Baldassano, R., Nessel, L., Li, H., Bushman, FD, & Lewis, JD (2011). Verknüpfung langfristiger Ernährungsmuster mit darmmikrobiellen Enterotypen. Wissenschaft (New York, NY), 334(6052), 105-108. https://doi-org.proxy.library.georgetown.edu/10.1126/science.1208344
Dieser Artikel erschien ursprünglich auf Neuronen kennen






















