 Wissenschaftler fügten ein Gen für einen Grünlichtrezeptor in die Augen blinder Mäuse ein, und einen Monat später bewegten sich die Mäuse so leicht um Hindernisse wie solche ohne Sehprobleme.
Wissenschaftler fügten ein Gen für einen Grünlichtrezeptor in die Augen blinder Mäuse ein, und einen Monat später bewegten sich die Mäuse so leicht um Hindernisse wie solche ohne Sehprobleme.
Die Mäuse konnten Bewegungen und Helligkeitsänderungen im tausendfachen Bereich sowie feine Details auf einem iPad erkennen, die ausreichten, um Buchstaben zu unterscheiden.
Die Forscher sagen, dass die Gentherapie, die sie über ein inaktives Virus verabreicht haben, bereits in drei Jahren an Menschen getestet werden könnte, die aufgrund einer Netzhautdegeneration ihr Augenlicht verloren haben. Im Idealfall könnte ihnen die Sehkraft wieder so weit gegeben werden, dass sie sich bewegen können und möglicherweise auch wieder lesen oder Videos ansehen können.
„Man injizierte einer Person dieses Virus ins Auge und ein paar Monate später konnte sie etwas sehen“, sagt Ehud Isacoff, Professor für Molekular- und Zellbiologie an der University of California in Berkeley und Direktor des Helen Wills Neuroscience Institute.
„… wie wunderbar wäre es für blinde Menschen, wieder einen normalen Computerbildschirm lesen, per Video kommunizieren und einen Film ansehen zu können.“
Bei neurodegenerativen Erkrankungen der Netzhaut versucht man oft nur, die weitere Degeneration zu stoppen oder zu verlangsamen. Aber dass man innerhalb weniger Monate ein Bild wiederherstellen kann – das ist schon erstaunlich.“
Weltweit leiden rund 170 Millionen Menschen an der altersbedingten Makuladegeneration, die jeden zehnten Menschen über 10 trifft. 55 Millionen Menschen weltweit leiden an der häufigsten Form erblicher Blindheit, der Retinitis pigmentosa, die typischerweise im Alter von 1.7 Jahren zur Erblindung führt.
„Ich habe Freunde, die kein Licht wahrnehmen können, und ihr Lebensstil ist herzzerreißend“, sagt John Flannery, Professor für Molekular- und Zellbiologie an der School of Optometry.
Sie müssen berücksichtigen, was sehende Menschen als selbstverständlich ansehen. Beispielsweise ist jedes Hotelzimmer ein wenig anders gestaltet, und sie brauchen jemanden, der sie durch das Zimmer führt, während sie im Kopf eine 3D-Karte erstellen. Alltagsgegenstände wie ein niedriger Couchtisch können eine Sturzgefahr darstellen. Menschen mit schwerem, behinderndem Sehverlust sind von der Krankheitslast enorm betroffen, und sie könnten die ersten Kandidaten für diese Art der Therapie sein.
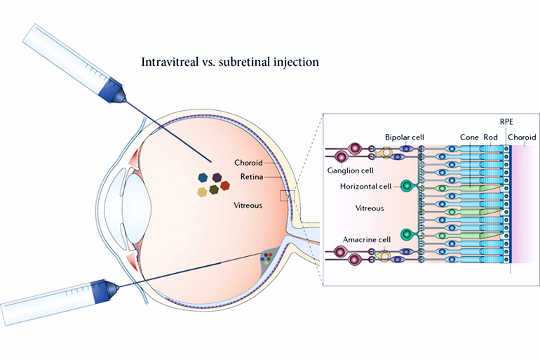 Bei der neuen Therapie werden inaktivierte Viren in den Glaskörper injiziert, um ein Gen direkt in die Ganglienzellen zu transportieren. Frühere Versionen der Virustherapie erforderten die Injektion der Viren unter die Netzhaut (unten). (Bildnachweis: John Flannery)
Bei der neuen Therapie werden inaktivierte Viren in den Glaskörper injiziert, um ein Gen direkt in die Ganglienzellen zu transportieren. Frühere Versionen der Virustherapie erforderten die Injektion der Viren unter die Netzhaut (unten). (Bildnachweis: John Flannery)
Derzeit beschränken sich die Behandlungsmöglichkeiten für solche Patienten auf ein elektronisches Augenimplantat, das an eine Videokamera angeschlossen ist, die wiederum auf einer Brille sitzt – ein umständliches, invasives und teures Verfahren, das auf der Netzhaut ein Bild erzeugt, das derzeit nur wenigen hundert Pixeln entspricht. Normales, scharfes Sehen hingegen umfasst Millionen von Pixeln.
Auch die Korrektur des für die Netzhautdegeneration verantwortlichen Gendefekts ist nicht einfach, da allein für Retinitis pigmentosa über 250 verschiedene Genmutationen verantwortlich sind. Etwa 90 Prozent dieser Mutationen töten die Photorezeptorzellen der Netzhaut ab – die Stäbchen, die für schwaches Licht empfindlich sind, und die Zapfen, die für die Farbwahrnehmung bei Tageslicht zuständig sind. Die Netzhautdegeneration verschont jedoch typischerweise andere Schichten der Netzhautzellen, darunter die bipolaren Zellen und die retinalen Ganglienzellen, die nach vollständiger Erblindung noch Jahrzehnte lang gesund, wenn auch lichtunempfindlich, bleiben können.
In ihren Versuchen an Mäusen gelang es den Forschern, 90 Prozent der Ganglienzellen lichtempfindlich zu machen.
Ein einfaches System
Um die Blindheit dieser Mäuse rückgängig zu machen, entwickelten die Forscher ein Virus, das auf retinale Ganglienzellen abzielte, und beluden es mit dem Gen für einen lichtempfindlichen Rezeptor, das grüne (mittelwellige) Zapfenopsin. Normalerweise exprimieren nur Zapfen-Photorezeptorzellen dieses Opsin und es macht sie empfindlich für grün-gelbes Licht. Als die Forscher das Virus ins Auge injizierten, transportierte es das Gen in die normalerweise lichtunempfindlichen Ganglienzellen und machte sie lichtempfindlich und befähigte sie, Signale an das Gehirn zu senden, die es als Sehen interpretierte.
„Soweit wir die Mäuse testen können, lässt sich das Verhalten der optogenetisch behandelten Mäuse ohne spezielle Ausrüstung nicht vom Verhalten normaler Mäuse unterscheiden“, sagt Flannery. „Es bleibt abzuwarten, welche Auswirkungen das auf einen Patienten hat.“
Bei Mäusen transportierten die Forscher die Opsine in die meisten Ganglienzellen der Netzhaut. Um Menschen zu behandeln, müssten sie deutlich mehr Viruspartikel injizieren, da das menschliche Auge tausendmal mehr Ganglienzellen enthält als das Mausauge. Das Team hat jedoch ein Verfahren entwickelt, um die Virusübertragung zu verbessern, und hofft, den neuen Lichtsensor in einen ähnlich hohen Prozentsatz von Ganglienzellen einzubringen – eine Menge, die der sehr hohen Pixelzahl einer Kamera entspricht.
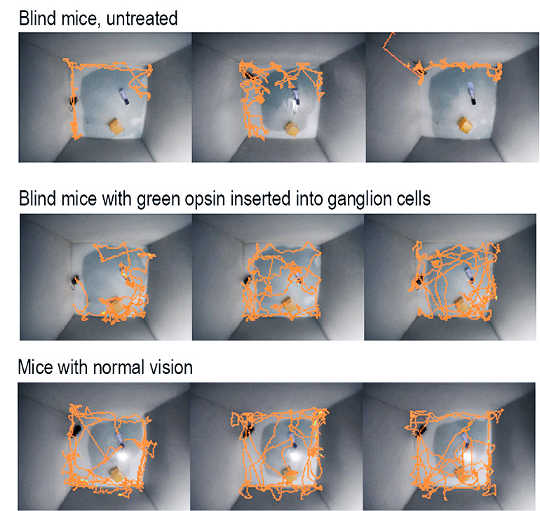 Die orangefarbenen Linien zeigen die Bewegungen von Mäusen in der ersten Minute, nachdem die Forscher sie in einen fremden Käfig gesetzt hatten. Blinde Mäuse (oben) halten sich vorsichtig in den Ecken und an den Seiten auf, während behandelte Mäuse (Mitte) den Käfig fast genauso intensiv erkunden wie normal sehende Mäuse (unten). (Bildnachweis: Ehud Isacoff/John Flannery)
Die orangefarbenen Linien zeigen die Bewegungen von Mäusen in der ersten Minute, nachdem die Forscher sie in einen fremden Käfig gesetzt hatten. Blinde Mäuse (oben) halten sich vorsichtig in den Ecken und an den Seiten auf, während behandelte Mäuse (Mitte) den Käfig fast genauso intensiv erkunden wie normal sehende Mäuse (unten). (Bildnachweis: Ehud Isacoff/John Flannery)
Isacoff und Flannery entdeckten die einfache Lösung, nachdem sie über ein Jahrzehnt lang kompliziertere Methoden ausprobiert hatten. Dazu gehörte das Einsetzen gentechnisch veränderter Neurotransmitterrezeptoren und lichtempfindlicher chemischer Schalter in überlebende Netzhautzellen. Diese funktionierten zwar, erreichten aber nicht die Empfindlichkeit des normalen Sehens. Auch anderswo getestete Opsine von Mikroben zeigten eine geringere Empfindlichkeit und erforderten den Einsatz lichtverstärkender Brillen.
Um die hohe Empfindlichkeit des natürlichen Sehens zu erfassen, untersuchten die Forscher die Lichtrezeptor-Opsine von Photorezeptorzellen. Mithilfe eines Adeno-assoziierten Virus, das Ganglienzellen auf natürliche Weise infiziert, gelang es ihnen, das Gen für ein retinales Opsin in das Genom der Ganglienzellen einzuschleusen. Die zuvor blinden Mäuse erlangten dadurch ein lebenslanges Sehvermögen.
„Dass dieses System funktioniert, ist wirklich sehr befriedigend, auch weil es so einfach ist“, sagt Isacoff. „Ironischerweise hätte man das schon vor 20 Jahren machen können.“
Die Forscher sammeln derzeit Geld, um die Gentherapie innerhalb von drei Jahren in einer klinischen Studie zu testen. Ähnliche AAV-Trägersysteme wurden von der FDA für die Behandlung von Augenerkrankungen bei Menschen mit degenerativen Netzhauterkrankungen zugelassen, für die es keine medizinische Alternative gibt.
Trotz aller Widrigkeiten
Laut Flannery und Isacoff würden die meisten Menschen, die sich mit dem Sehen beschäftigen, bezweifeln, dass Opsine auch außerhalb ihrer spezialisierten Stäbchen- und Zapfen-Photorezeptorzellen wirken können. Die Oberfläche eines Photorezeptors ist mit Opsinen besetzt – Rhodopsin in Stäbchen und rote, grüne und blaue Opsine in Zapfen –, die in eine komplexe molekulare Maschine eingebettet sind. Ein molekulares Relais – die G-Protein-gekoppelte Rezeptor-Signalkaskade – verstärkt das Signal so effektiv, dass wir einzelne Lichtphotonen wahrnehmen können.
Ein Enzymsystem lädt das Opsin wieder auf, sobald es das Photon erkennt und „gebleicht“ wird. Durch Rückkopplungsregulation passt sich das System an sehr unterschiedliche Hintergrundhelligkeiten an. Ein spezialisierter Ionenkanal erzeugt zudem ein starkes Spannungssignal. Ohne die Transplantation dieses gesamten Systems lag die Vermutung nahe, dass das Opsin nicht funktionieren würde.
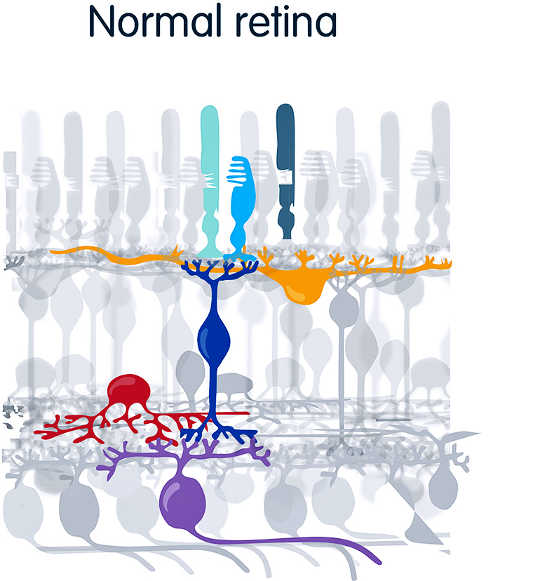 In einer normalen Netzhaut erfassen Photorezeptoren – Stäbchen (blau) und Zapfen (grün) – das Licht und leiten Signale an andere Schichten des Auges weiter. Sie enden in den Ganglienzellen (violett), die direkt mit dem Sehzentrum des Gehirns kommunizieren. (Bildnachweis: UC Berkeley)
In einer normalen Netzhaut erfassen Photorezeptoren – Stäbchen (blau) und Zapfen (grün) – das Licht und leiten Signale an andere Schichten des Auges weiter. Sie enden in den Ganglienzellen (violett), die direkt mit dem Sehzentrum des Gehirns kommunizieren. (Bildnachweis: UC Berkeley)
Doch Isacoff, der sich auf G-Protein-gekoppelte Rezeptoren im Nervensystem spezialisiert hat, wusste, dass viele dieser Bestandteile in allen Zellen vorkommen. Er vermutete, dass sich ein Opsin automatisch mit dem Signalsystem der retinalen Ganglienzellen verbinden würde. Gemeinsam mit Flannery probierte er zunächst Rhodopsin aus, das lichtempfindlicher ist als Zapfenopsine.
Zu ihrer Freude führten sie Rhodopsin in die Ganglienzellen von Mäusen ein, deren Stäbchen und Zapfen vollständig degeneriert und die deshalb blind waren. Die Tiere erlangten daraufhin die Fähigkeit zurück, Dunkelheit von Hell zu unterscheiden – sogar schwaches Zimmerlicht. Rhodopsin erwies sich jedoch als zu langsam und versagte bei der Bild- und Objekterkennung.
Anschließend testeten sie das Grünzapfenopsin, das zehnmal schneller reagierte als Rhodopsin. Bemerkenswerterweise konnten die Mäuse parallele von horizontalen Linien, eng beieinanderliegende von weit auseinanderliegenden Linien (eine Standardaufgabe für die menschliche Sehschärfe) sowie bewegte von ruhenden Linien unterscheiden. Das wiederhergestellte Sehvermögen war so empfindlich, dass iPads anstelle deutlich hellerer LEDs als visuelle Anzeige verwendet werden konnten.
„Das hat die Botschaft eindrucksvoll vermittelt“, sagt Isacoff. „Schließlich wäre es wunderbar, wenn blinde Menschen wieder einen normalen Computerbildschirm lesen, per Video kommunizieren und Filme ansehen könnten.“
Diese Erfolge veranlassten Isacoff und Flannery, einen Schritt weiterzugehen und herauszufinden, ob Tiere mit wiederhergestelltem Sehvermögen in der Welt navigieren können. Erstaunlicherweise war auch hier das grüne Zapfenopsin ein Erfolg. Blinde Mäuse erlangten die Fähigkeit zurück, eines ihrer natürlichsten Verhaltensweisen auszuführen: das Erkennen und Erkunden dreidimensionaler Objekte.
Sie stellten sich dann die Frage: „Was würde passieren, wenn eine Person mit wiederhergestelltem Sehvermögen in helleres Licht hinausgeht? Würde sie vom Licht geblendet werden?“ Dabei kristallisierte sich laut Isacoff eine weitere bemerkenswerte Eigenschaft des Systems heraus: Der Opsin-Signalweg des Grünzapfens passt sich an. Tiere, die zuvor blind waren, passten sich der Helligkeitsänderung an und konnten die Aufgabe genauso gut bewältigen wie sehende Tiere. Diese Anpassung funktionierte über einen etwa tausendfachen Bereich – im Wesentlichen den Unterschied zwischen durchschnittlicher Innen- und Außenbeleuchtung.
„Wenn alle sagen, dass es nie funktionieren wird und man verrückt ist, bedeutet das normalerweise, dass man etwas auf der Spur ist“, sagt Flannery. Und tatsächlich ist es die erste erfolgreiche Wiederherstellung des Mustersehens mithilfe eines LCD-Computerbildschirms, die erste Anpassung an Veränderungen des Umgebungslichts und die erste Wiederherstellung des natürlichen Objektsehens.
Die Forschung erscheint in Nature Communications veröffentlicht Das Team testet derzeit Variationen dieses Themas, die das Farbsehen wiederherstellen und die Sehschärfe sowie die Anpassungsfähigkeit weiter verbessern könnten. Das National Eye Institute der National Institutes of Health, das Nanomedicine Development Center for the Optical Control of Biological Function, die Foundation for Fighting Blindness, die Hope for Vision Foundation und das Lowy Medical Research Institute unterstützten die Forschung.
Quelle: UC Berkeley
Bücher zum Thema
{amazonWS:searchindex=Books;keywords=blindness cures;maxresults=3}















